Los científicos logran por primera vez regenerar ‘in vivo’ la piel de un mamífero
Una investigación en ratones abre vías para tratar grandes quemaduras, úlceras cutáneas y otras heridas muy graves
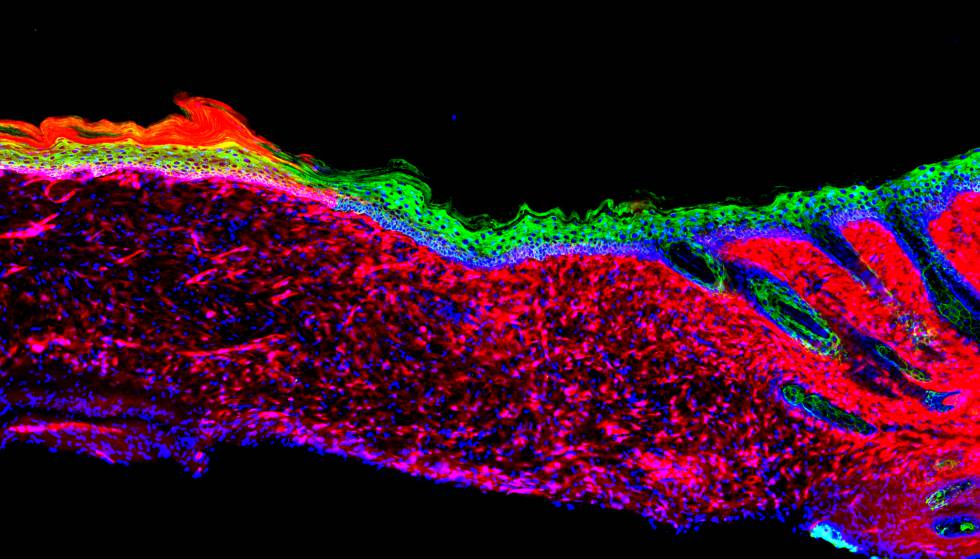
Es justo lo que los mamíferos no podemos hacer: regenerar nuestros órganos, como hacen la salamandra o el ajolote mexicano. Y también es el sueño de la medicina regenerativa, o de la medicina en su conjunto. En algún momento de la evolución animal, los mamíferos perdimos ese talento vivificador y curativo. Pero los científicos han logrado recuperarlo, al menos en ratones, y al menos para un órgano esencial, la piel. Si la técnica resulta extrapolable a las personas, supondrá un salto de gigante para tratar grandes quemaduras, úlceras cutáneas y otras heridas muy graves. También para reparar los efectos del envejecimiento sobre la piel.
La investigación en medicina regenerativa se ha centrado hasta ahora en obtener células de un animal –a veces de un paciente—, reprogramarlas fuera del cuerpo (‘ex vivo’, en la jerga), diferenciarlas en los tejidos necesarios y reimplantarlas al cuerpo. Esta es la primera investigación que logra hacer todo eso ‘in vivo’, reprogramando las células dentro del cuerpo, de modo que sean ellas mismas quienes proliferen y regeneren el órgano dañado, la piel en este caso. Es lo más parecido al estilo del ajolote que la ciencia ha alcanzado de momento.
“El trabajo se centra en la posibilidad de regenerar grandes superficies de piel para tratar grandes quemados, grandes úlceras como, por ejemplo, en determinados casos de diabetes y otras”, dice Juan Carlos Izpisúa, del Instituto Salk de California, autor principal de la investigación que se presenta en Nature. “Son problemas clínicos muy graves, para los que hoy no existe un tratamiento adecuado y que muchas veces llevan a la muerte del paciente”.

El científico del Salk prosigue: “La posibilidad de regenerar la piel in vivo, en el propio paciente, si se pudiera llevar a la práctica en humanos, sería un avance importante para la medicina en general, no solo en el campo de la medicina regenerativa sino en otros campos como puede ser la cirugía plástica, cáncer de piel, o el deterioro natural de la piel como consecuencia del envejecimiento”. Esto último daría escalofríos si uno lo pusiera en euros, cosa que nadie ha hecho de momento.
Las úlceras cutáneas que se extienden por todas las capas de la piel (epidermis en la parte exterior, endodermis en la interior) pueden tratarse ahora con implantes de piel de otra parte del cuerpo, pero esto es inviable con úlceras muy grandes, porque no tenemos tanta piel sobrante, o prescindible. La opción que queda ahí, todavía experimental, es extraer células madre de la piel (es decir, las células madre que generan todos los tipos celulares de la piel), cultivarlas en el laboratorio y reimplantar la piel resultante al paciente. Esto lleva mucho tiempo, a veces más del que le queda de vida al paciente.
Izpisúa y otro de los autores de la investigación, Masakazu Kurita, que fue cirujano plástico antes que investigador del Salk, sabían que el elemento clave de la reparación de una úlcera o una quemadura, en condiciones naturales, es que unas células llamadas “queratinocitos basales” –las células madre de la piel— migren desde las zonas sanas adyacentes hasta la herida. Como su función es proliferar y producir todos los tipos celulares de la piel, pueden regenerarla en condiciones favorables.
Pero, como es obvio, esto no funciona con heridas graves. Y funciona cada vez peor con la edad, incluso con heridas leves. “Nos propusimos hacer piel donde no había piel para empezar”, dice Kurita con concisión oriental.
Reprogramación
La búsqueda de los factores necesarios para la reprogramación de las células de la herida en queratinocitos (las células madre de la piel) ha sido un trabajo detectivesco y extenuante. La genómica les permitió detectar primero 55 moléculas (proteínas, ARN) candidatas a lograr la reprogramación, y luego la combinatoria de prueba y error ha estrechado el cerco hasta solo cuatro moléculas esenciales.

Basta la aplicación tópica de esos cuatro factores sobre la herida para que las células se conviertan en queratinocitos y estos regeneren una piel sana en 18 días. Después, esa piel nueva se expande y se conecta con la piel normal circundante. Y todo sigue bien seis meses después, por toda clase de criterios genéticos, bioquímicos y citológicos.
La aplicación a humanos no va a ser inmediata. “Antes de llegar a ensayos clínicos”, dice Kurita, “tenemos que hacer más estudios de seguridad a largo plazo y aumentar la eficiencia todo lo posible”.
Para Izpisúa, lo más importante es que esta es la primera vez que se consigue la regeneración en un mamífero. “Se supone, al menos eso dicen los libros de texto, que los mamíferos no se regeneran. Pero ahora tenemos un tejido tridimensional formado in vivo por distintos tipos celulares, a partir del propio organismo, y sin necesidad de un trasplante externo”. Es el sueño del ajolote.


No hay comentarios:
Publicar un comentario